Recherche sur l'œil, l'apport primordial de la culture cellulaire
Sans eux, la science moderne ne serait que l’ombre d’elle-même. Eux, ce sont les modèles et cultures cellulaires. Et celles et ceux qui les élaborent. Ces outils sont devenus incontournables pour l’avancée des connaissances, en ophtalmologie comme dans le reste de la recherche en biologie. Découverte de certains des modèles utilisés à l’Institut de la Vision, avec une des personnes qui les a mis au point, Valérie Forster.
La carrière de Valérie Forster est, aux dires de l’intéressée, un exemple de situation où l’ascenseur social a bien fonctionné. Il y a trente ans, après une terminale en biotechnologies et des petits boulots divers, la toute jeune Valérie Forster cherche dans sa branche et trouve au début des années 1990 un stage d’insertion à mi-temps (à l’époque Travail d’Utilité Collective) au centre de Neurochimie du CNRS à Strasbourg. De vacations en contrats courts, elle y restera plusieurs années comme adjointe technique de recherche et se forme aux bases de la culture cellulaire des neurones et cellules associées, au sein de l’équipe de « Neurodifférenciation », dirigée par Henri Dreyfus.

Valérie Forster, ingénieure d’étude. Responsable opérationnelle des espaces de culture cellulaire à l’Institut de la Vision.
Au bon endroit, au bon moment ?
C’est l’époque où Henri Dreyfus est contacté par celui qui n’est pas encore le Professeur Sahel, mais simplement le médecin José-Alain Sahel. Lorsque, avec David Hicks, les trois hommes lancent en 1992 l’aventure de l’équipe de « Physiopathologie rétinienne », qui aboutira à la création de l’Institut de la Vision plus de 15 ans plus tard. Valérie Forster se voit confier la salle de culture. Il faut dire qu’entre temps, elle est « tombée dans la marmite, comme Obélix, et je ne pouvais plus m’en passer », se remémore la cinquantenaire dans un sourire. « J’ai immédiatement aimé la culture cellulaire. Peut-être parce que j’adore cuisiner, et qu’il y a de nombreux points communs. J’aime observer le résultat de mon travail au microscope, qu’on puisse voir en direct des cellules vivantes, qui réagissent à ce qu’on leur fait dans nos boîtes de culture, » détaille-t-elle. Le travail de recherche académique, les collaborations avec d’autres équipes lui plaisent également beaucoup, et rapidement, elle ne se voit plus quitter les laboratoires, même si au départ, du fait de son poste très modeste, son champ d’action y est limité.
« Valérie Forster est l'experte sur le sujet de la culture cellulaire à l'Institut de la Vision »
Serge Picaud, directeur de l'Institut de la Vision .
Une évolution interne par validation des acquis
Dès 1999, soutenue par le jeune Serge Picaud, qui vient de rejoindre l’équipe à son retour des USA, elle passe l’examen du BTS par validation des acquis professionnels et l’obtient. Elle sera ensuite recrutée en 2003 par l’INSERM comme assistante ingénieure. Son directeur de jury de concours est à l’époque directeur de l'École Pratique des Hautes Etudes. Il l’encourage à faire une formation diplômante au sein de son établissement, ce qui lui permet en parallèle de son travail au laboratoire, d’obtenir en trois ans un diplôme de niveau Master 2. Elle le décroche en 2006 et sera reçue au concours interne d’ingénieur d’étude par l’INSERM en 2013. Cette progression de statut va avec une augmentation graduelle des responsabilités, jusqu’à ce qu’elle se voit confier la gestion opérationnelle de la plateforme de culture cellulaire de l’Institut de la Vision. Elle devient au fur et à mesure de son évolution « l’experte sur le sujet de la culture cellulaire à l’Institut de la vision, et développe une large part des modèles cellulaires utilisés à l’Institut. Son parcours par la validation des acquis professionnels est très inspirant » note Serge Picaud, actuel directeur de l’Institut de la Vision. C’est sur certains de ces nouveaux types de cultures cellulaires, mis au point par Valérie Forster, que nous allons nous arrêter.

© Valérie Forster. Institut de la Vision
Cultiver des neurones in vitro, une première révolution
La mise au point de ces modèles cellulaires est étroitement liée à l’histoire de la création de l’Institut de la Vision (voir l'article "L'Institut de la Vision, histoire d'une pugnacité collective" ). Ainsi, se remémore Valérie Forster, dans ses premières années d’existence « l’équipe de Physiopathologie rétinienne trouve des locaux proches de la clinique ophtalmologique de l’hôpital civil de Strasbourg. Nous avons eu la chance de pouvoir accéder à des yeux humains ». La littérature scientifique de l’époque considère comme admis que les neurones ne peuvent survivre en culture que lorsqu’ils sont prélevés à un stade immature. Or, la plupart des pathologies rétiniennes apparaissent avec l’âge, donc dans des rétines matures. Puisqu’elle a accès à des yeux humains, l’équipe décide de tenter de mettre en culture ces cellules soi-disant incultivables. Elle expérimente avec différentes solutions enzymatiques pour digérer le tissu rétinien, mettre ses cellules en suspension, puis les laisser s’organiser en tapis cellulaire dans des boîtes de culture où il s’agit de les faire au minimum survivre, au mieux se multiplier in vitro. A force de ténacité, en testant différentes conditions, Valérie Forster et ses collègues mettent au point un protocole qui fonctionne sur les rétines humaines. Mais, pour des raisons évidentes, les yeux humains sont très difficiles à obtenir, ils sont donc conservés pour des recherches avancées. L’équipe se met en quête d’un modèle animal qui se rapproche le plus possible de l’œil humain. A cette époque de la vache folle, ce sera l’œil de porc, que les chercheurs peuvent obtenir quotidiennement grâce à un partenariat avec un abattoir.
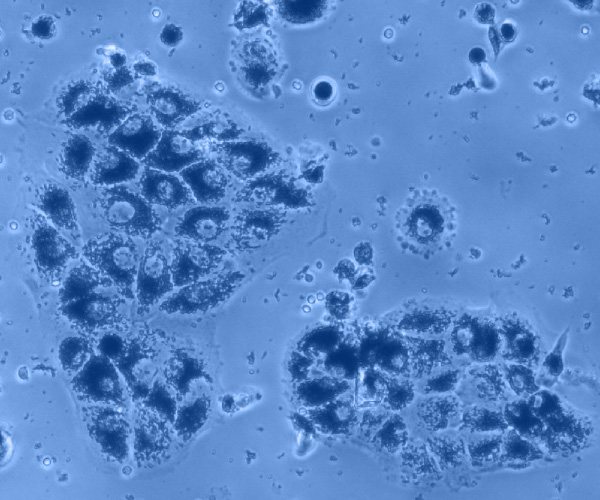
Cellules cultivées in vitro et observées au microscope à contraste de phase : cellules de l’épithélium pigmenté rétinien © Valérie Forster. Institut de la Vision
Des cultures de rétine aux cultures enrichies
Le défi suivant va donc consister, pour répondre aux attentes des chercheurs, à trouver le moyen d’enrichir les cultures cellulaires en photorécepteurs ou en cellules ganglionnaires (ces dernières ne représentent que 1% des cellules de la rétine humaine). L’objectif est de s’émanciper des cinq autres types cellulaires qui composent la rétine et d’obtenir des cultures dites « pures ». Une première étape va consister à ne dissocier qu’une partie de la rétine, celle qui contient les cellules d’intérêt. Pour cela, il va falloir se former à l’utilisation du vibratome, une lame de rasoir vibrante qui permet de couper la rétine en deux dans le sens de l’épaisseur, alors qu’elle ne fait que 0,15 à 0,4 millimètres. Une petite prouesse de technicité que Valérie Forster mentionne à peine. Interrogée sur la question, elle reconnaît modestement que cela demande effectivement une grande précision de geste, semblable à celle de la haute joaillerie. « C’est le résultat de beaucoup beaucoup de travail, mais c’est vrai que quand je pose les yeux sur le microscope, j’oublie le temps », sourit-elle. Avant de reprendre : « Il faut passer des heures à pratiquer, apprendre à regarder les cellules, les tissus, savoir se repérer dans la rétine. C’est ce que j’essaye de transmettre lorsque j’enseigne la culture cellulaire aux étudiants et ingénieurs qui arrivent à l’Institut ».
Si, ensuite, le maintien en culture de photorécepteurs adultes s’avère plus compliqué que juste de dissocier la couche qui les contient, l’équipe fini par mettre au point un protocole concluant. Celui-ci, sur une idée de Serge Picaud, alors post-doctorant dans l’équipe, tire parti des fonctions nourricières d’un tapis de cellules gliales sur lequel se développent les photorécepteurs. Dans de telles conditions, les cellules survivent plusieurs semaines, et il devient possible d’enregistrer leur activité neurale individuelle. C’est sur la base de ce travail, et des publications scientifiques qui lui sont associées et ont suivi, que Serge Picaud obtiendra son poste à l’INSERM.

« Il faut passer des heures à pratiquer, apprendre à regarder les cellules, les tissus, savoir se repérer dans la rétine »
Valérie Forster, Institut de la Vision.
Des cultures enrichies aux culture pures
Si la coupe au vibratome permet d’enrichir la culture cellulaire en photorécepteurs, elle ne permet pas de se séparer des batônnets. Restait donc à sélectionner les photorécepteurs à cônes pour obtenir des cultures dites « pures ». L’équipe se forme à une technique permettant de purifier les cellules ganglionnaires, publiée par d’autres chercheurs. Leur méthode, très simple, consiste à tapisser le fond d’une boîte de culture d’un anticorps spécifique d’un type cellulaire. Lorsqu’on y dépose une suspension de cellules de la rétine, seules les cellules d’intérêt adhèrent à l’anticorps. Il suffit ensuite de laver la boîte avec du milieu de culture pour éliminer les autres neurones. Forts de cette formation, les membres de l’équipe en charge de la culture cellulaire développent un protocole adapté aux photorécepteurs à cônes, qu’ils brevètent en 2004. Ces deux cultures cellulaires pures permettent de faire aussi bien de l’électrophysiologie, l’enregistrement de l’activité cellulaire, que des tests de toxicité ou d’efficacité pharmacologique de molécules. Plus récemment, elles ont permis de démontrer que l’intensité lumineuse dans notre pays au mois d'août peut tuer les photorécepteurs à cônes lors d’une exposition prolongée. De plus, une étude en cours, utilisant ces mêmes cellules, a permis d’élucider un nouveau mécanisme de mort cellulaire pouvant expliquer et peut-être traiter certaines pathologies comme la DMLA.
Le régime omnivore, source (quasi) illimitée de cellules rétiniennes
Mis à part les cellules de l’épithélium rétinien, les cellules rétiniennes qui sont des neurones ne peuvent plus se multiplier à l’âge adulte. Pour obtenir les différentes cultures cellulaires qui servent de substrat aux expériences scientifiques des chercheurs, il est donc nécessaire de partir directement de rétines, qui sont ensuite découpées ou dissociées en leurs composants cellulaires, selon les besoins des expériences. Mais contrairement à la peau par exemple, ou au foie, qui sont des tissus que l’on peut facilement prélever et qui vont repousser, il n’est possible d’avoir accès à la rétine qu’en obtenant un œil entier, qui sera détruit dans le processus. On comprend donc aisément que la disponibilité des yeux humains pour la recherche n’est pas très grande. Si l’œil qui se rapproche le plus de l’œil humain est celui du macaque, les considérations éthiques limitent là aussi la disponibilité de la ressource. Heureusement pour notre quête de la connaissance, d’autres yeux ont pu être mis à profit. C’est le cas notamment des yeux du porc. Ceux-ci présentent en effet de nombreux avantages même s’ils sont dichromates et non trichromates comme les primates. C’est-à-dire que leurs photorécepteurs à cônes permettent de voir en deux couleurs et non trois, ils ne voient que le vert et le bleu mais pas le rouge. La taille des yeux du porc, et celle de leurs cellules rétiniennes, sont cependant similaires à celle des yeux humains. Par contre, les cellules rétiniennes de souris sont de l’ordre de six fois plus petites que les cellules humaines. De plus, même si les yeux de porc ne présentent pas de fovéa, ils possèdent une région où se concentrent les photorécepteurs à cônes. Ceux-ci sont même quatre fois plus nombreux dans les yeux de porcs (20%) que dans les yeux humains (5%), ce qui présente un intérêt certain pour l’étude de ce type cellulaire. Enfin, ces yeux venant des abattoirs, nous avons accès à une ressource quasi illimitée d’yeux utilisables en recherche.
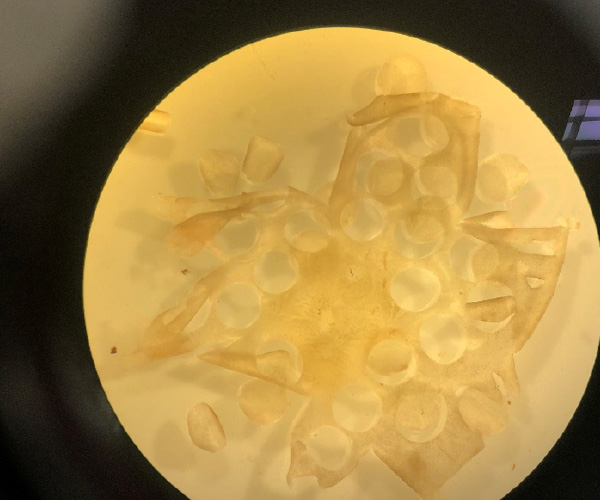
Découpage d’une rétine de grande taille (porc, primate) en une vingtaine d’explants de diamètre 3 mm © Valérie Forster. Institut de la Vision
Les explants, pour tirer le meilleur parti des rétines
Si les cultures pures sont une immense avancée technique, au potentiel considérable, il est parfois essentiel de conserver le tissu rétinien avec son architecture synaptique intègre. C’est ainsi que sont nés les explants, des morceaux de rétine maintenus fonctionnels ex vivo. Découpés grâce à de minuscules emporte-pièces de 1 à 8 mm de diamètre, ils conservent l’architecture de la rétine et donc ses interactions cellulaires. Si les explants existaient avant que l’équipe des Dr Dreyfus, Sahel et Hicks ne se saisissent du concept, le protocole était peu reproductible. En effet, plongée dans le milieu de culture comme l’étaient jusqu’ici les explants, la rétine se contracte et n’est pas oxygénée correctement. Elle finit par mourir en quelques heures, ce qui ne laisse pas le temps de faire des expériences qui peuvent durer entre une et deux semaines. Il faudra donc là encore mettre au point une nouvelle méthode, qui prendra la forme d’une membrane perméable qui permet à l’explant de rester à plat, de ne pas être submergé, et de s’oxygéner au contact de l’air.
L’équipe parvient ainsi à garder un mois des explants de rétine ex vivo. En utilisant cet outil sur des modèles murins de rétinite pigmentaire, l’équipe a ainsi pu montrer que les phénomènes de dégénérescence se produisent y compris ex vivo. Une opportunité rare de les suivre, littéralement, au microscope, et de tester d’éventuels facteurs de protection. C’est ainsi que le regretté Thierry Leveillard, directeur de recherche INSERM à l’Institut de la Vision, découvrira le RdCVF (pour Rod-derived Cone Viability Factor), facteur de survie des cônes produit par les batônnets. « Parce qu’ils permettent, à partir d’une même rétine, d’obtenir de nombreux échantillons et donc de multiplier par autant le nombre de molécules ou vecteurs testés, ces explants sont de précieux outils de recherche, » souligne Valérie Forster. Développés sur la rétine humaine pour la validation des approches translationnelles, ils ont ainsi permis la mise au point d’une technique de réactivation de la sensibilité des photorécepteurs à la lumière par Deniz Dalkara, ce qui a participé à l’obtention de son poste de chargée de recherche INSERM à l’Institut de la Vision et de chef d’équipe Thérapies géniques et modèles animaux des maladies neurodégénératives.

© Valérie Forster. Institut de la Vision
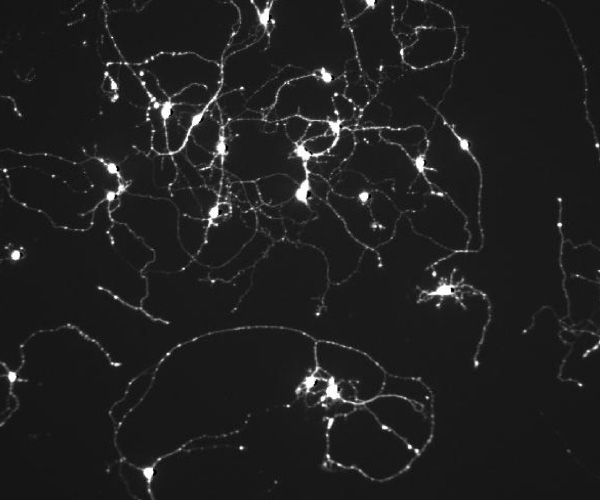
Cellules ganglionnaires marquées par la calcéine (marqueur de viabilité) © Valérie Forster. Institut de la Vision
Passage au crible de l'épithélium pigmentaire
La recherche en biologie a fréquemment recours au criblage, le test de très nombreuses molécules sur un type de cellules en culture. Si celui-ci était auparavant fait manuellement, il a bénéficié ces dernières décennies d’une très forte automatisation, et de l’optimisation de son efficience. Les cellules, en suspension, sont ainsi distribuées dans des plaques de culture possédant jusqu’à 384 alvéoles, qui vont servir à tester en parallèle l’effet de très nombreuses molécules sur la culture cellulaire en utilisant un minimum de cellules, et d’espace.
Un des modèles cellulaires cible de ce type de criblage est l’épithélium pigmentaire, la couche située juste derrière la rétine. Essentiel au fonctionnement des photorécepteurs, cet épithélium a plusieurs fonctions, dont le recyclage du pigment visuel et le renouvellement de la partie photosensible des photorécepteurs. Les maladies qui impactent ces cellules entrainent donc des pathologies cécitantes, ce qui dit l’importance de la recherche sur les facteurs de leur survie. Une étude a ainsi démontré la toxicité de la lumière bleue pour la rétine dans un modèle de vieillissement.
Le protocole d’obtention de ce modèle consiste à ouvrir l’œil, enlever la rétine et venir détacher délicatement, à l’aide d’une enzyme, la couche de cellules épithéliales qui recouvre sa face arrière, avant de les mettre en culture dans des plaques multipuits. Celles-ci permettent ensuite de cribler de grandes banques de molécules, dans l’espoir d’en trouver qui soit neuroprotectrices.

Mise en culture d’explants rétiniens (porc, primate) sur membrane en polycarbonate © Valérie Forster. Institut de la Vision
… Et des photorécepteurs
Depuis une dizaine d’années, l’ingénieur d’étude poursuivait l’objectif d’obtenir la survie des photorécepteurs adultes seuls pour le criblage de molécules protectrices. Mais de nombreuses personnes lui disaient que c’était impossible à faire sur des neurones. Dernièrement, Valérie Forster et Manon Leclercq, doctorante en troisième année dans l’équipe de Serge Picaud, ont pourtant réussi à adapter la technique pour les photorécepteurs à cônes. Cette innovation majeure, qui a nécessité le contrôle de tous les facteurs critiques pour la survie de ces cellules très fragiles, a été brevetée en septembre 2023. « La recherche est souvent menée par des scientifiques de renom mais la réalisation tient parfois aux exploits techniques de certains agents. Les résultats sont issus d’un collectif. Valérie a ainsi mis au point des protocoles de culture des cellules rétiniennes maitrisés exclusivement dans notre institut » commente Serge Picaud.
Soutenez la recherche , soutenez l'Institut de la Vision >

Propos recueillis par Aline Aurias
À lire aussi

La rétinopathie diabétique

Entretien avec Pr José-Alain Sahel, retour sur l'histoire de l'Institut de la Vision Paris
À l'occasion de notre reportage exceptionnel sur l'Institut de la Vision Paris, la rédaction du Guide de la Vue a eu le plaisir et le privilège de s'entretenir avec le Pr José-Alain Sahel, afin qu'il partage avec nous sa vision sur cette grande

13 avancées majeures à l'Institut de la Vision
Si le temps de la recherche paraît souvent très long, et tout particulièrement pour les patients atteints de pathologies ne disposant d'aucun traitement, la recherche sur les maladies de la vision a








